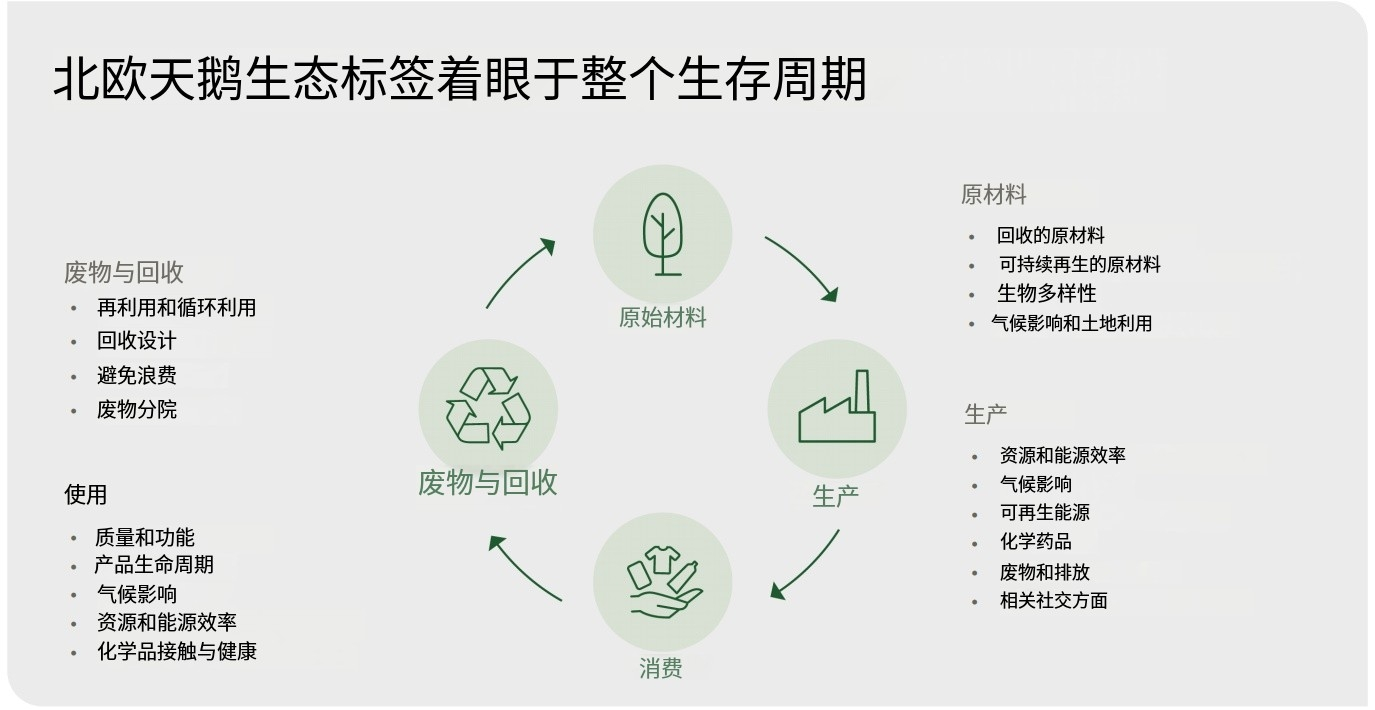
质量管理体系要求:涵盖组织结构、职责和权限、质量管理体系所需的过程、资源管理、产品实现、测量分析和改进等方面的要求。
医疗器械生产过程中的关键控制点:包括原材料的验收、生产过程的控制、成品检验等环节。要求企业在生产过程中严格遵守质量控制标准,确保产品质量。
培训和意识:要求企业进行定期的质量培训,提高员工的质量意识和技能水平。
记录和文件管理:要求企业建立完善的记录制度,确保产品质量可追溯。
ISO 13485认证的适用范围广泛,涵盖了医疗器械制造、组装、包装、配送和售后服务等多个环节。主要涉及的组织类型包括:
1. 医疗器械设计和制造商
2. 医疗器械经营商
3. 医疗器械服务提供方
4. 医疗器械软硬件开发商
5. 医疗器械零部件/材料供应商
前期准备:企业需确保管理体系的有效性,至少运行三个月并进行一次完整的内部审核和管理评审。对于生产植入性医疗器械产品的企业,体系运行时间应至少为6个月。
提交申请:企业填写完整的《ISO13485认证申请表》,并向认证机构提交申请表及相关文件和记录。
认证审核:认证机构对企业的质量管理体系进行审核,包括现场审核和文件审核。现场检查将按照ISO 13485标准和相对应的认证技术要求进行,包括对企业文件、生产现场、产品质量、环境保护等方面的检查。
认证决定:根据审核结果,认证机构决定是否授予企业ISO 13485认证。
颁发证书:认证机构向认证合格企业颁发环境标志认证证书,并进行公告和宣传。
年度监督检查:获得ISO 13485认证后,企业需要接受定期的认证复审,以确保其质量管理体系的持续有效性。
ISO 13485医疗器械管理体系认证的费用根据企业人数和认证机构有所区别,费用构成主要包括:
认证费用:根据认证机构的不同而有所差异。
咨询辅导费用:根据咨询公司的情况确定。
差旅费用:一般是实报实销,如果企业在当地,那么差旅费用会比较少。
计量器校准费用:根据企业的产品的复杂程度、计量设备的精度等会有所差别。
产品第三方检验费用:如果产品涉及的相应的标准,有些需要进行第三方测试,那么需要送达第三方实验室进行测试,会产生相应的测试费用。
提高产品质量:通过建立完善的质量管理体系,对医疗器械生产过程中的各个环节进行严格控制,从而提高产品的质量。
提升企业竞争力:有助于企业获取国际市场的通行证,提高企业在国际市场的竞争力。
减少风险:通过对生产过程中的关键控制点进行严格监控,可以降低医疗器械产品在临床应用中的风险,保障患者的安全。
促进创新和发展:注重员工的培训和意识提升,有利于激发员工的创新精神,推动企业的创新和发展。
实现可持续发展:通过实施ISO 13485体系,企业可以优化资源配置,提高生产效率,实现可持续发展。
质量管理体系要求:涵盖组织结构、职责和权限、质量管理体系所需的过程、资源管理、产品实现、测量分析和改进等方面的要求。
医疗器械生产过程中的关键控制点:包括原材料的验收、生产过程的控制、成品检验等环节。要求企业在生产过程中严格遵守质量控制标准,确保产品质量。
培训和意识:要求企业进行定期的质量培训,提高员工的质量意识和技能水平。
记录和文件管理:要求企业建立完善的记录制度,确保产品质量可追溯。
ISO 13485认证的适用范围广泛,涵盖了医疗器械制造、组装、包装、配送和售后服务等多个环节。主要涉及的组织类型包括:
1. 医疗器械设计和制造商
2. 医疗器械经营商
3. 医疗器械服务提供方
4. 医疗器械软硬件开发商
5. 医疗器械零部件/材料供应商
前期准备:企业需确保管理体系的有效性,至少运行三个月并进行一次完整的内部审核和管理评审。对于生产植入性医疗器械产品的企业,体系运行时间应至少为6个月。
提交申请:企业填写完整的《ISO13485认证申请表》,并向认证机构提交申请表及相关文件和记录。
认证审核:认证机构对企业的质量管理体系进行审核,包括现场审核和文件审核。现场检查将按照ISO 13485标准和相对应的认证技术要求进行,包括对企业文件、生产现场、产品质量、环境保护等方面的检查。
认证决定:根据审核结果,认证机构决定是否授予企业ISO 13485认证。
颁发证书:认证机构向认证合格企业颁发环境标志认证证书,并进行公告和宣传。
年度监督检查:获得ISO 13485认证后,企业需要接受定期的认证复审,以确保其质量管理体系的持续有效性。
ISO 13485医疗器械管理体系认证的费用根据企业人数和认证机构有所区别,费用构成主要包括:
认证费用:根据认证机构的不同而有所差异。
咨询辅导费用:根据咨询公司的情况确定。
差旅费用:一般是实报实销,如果企业在当地,那么差旅费用会比较少。
计量器校准费用:根据企业的产品的复杂程度、计量设备的精度等会有所差别。
产品第三方检验费用:如果产品涉及的相应的标准,有些需要进行第三方测试,那么需要送达第三方实验室进行测试,会产生相应的测试费用。
提高产品质量:通过建立完善的质量管理体系,对医疗器械生产过程中的各个环节进行严格控制,从而提高产品的质量。
提升企业竞争力:有助于企业获取国际市场的通行证,提高企业在国际市场的竞争力。
减少风险:通过对生产过程中的关键控制点进行严格监控,可以降低医疗器械产品在临床应用中的风险,保障患者的安全。
促进创新和发展:注重员工的培训和意识提升,有利于激发员工的创新精神,推动企业的创新和发展。
实现可持续发展:通过实施ISO 13485体系,企业可以优化资源配置,提高生产效率,实现可持续发展。